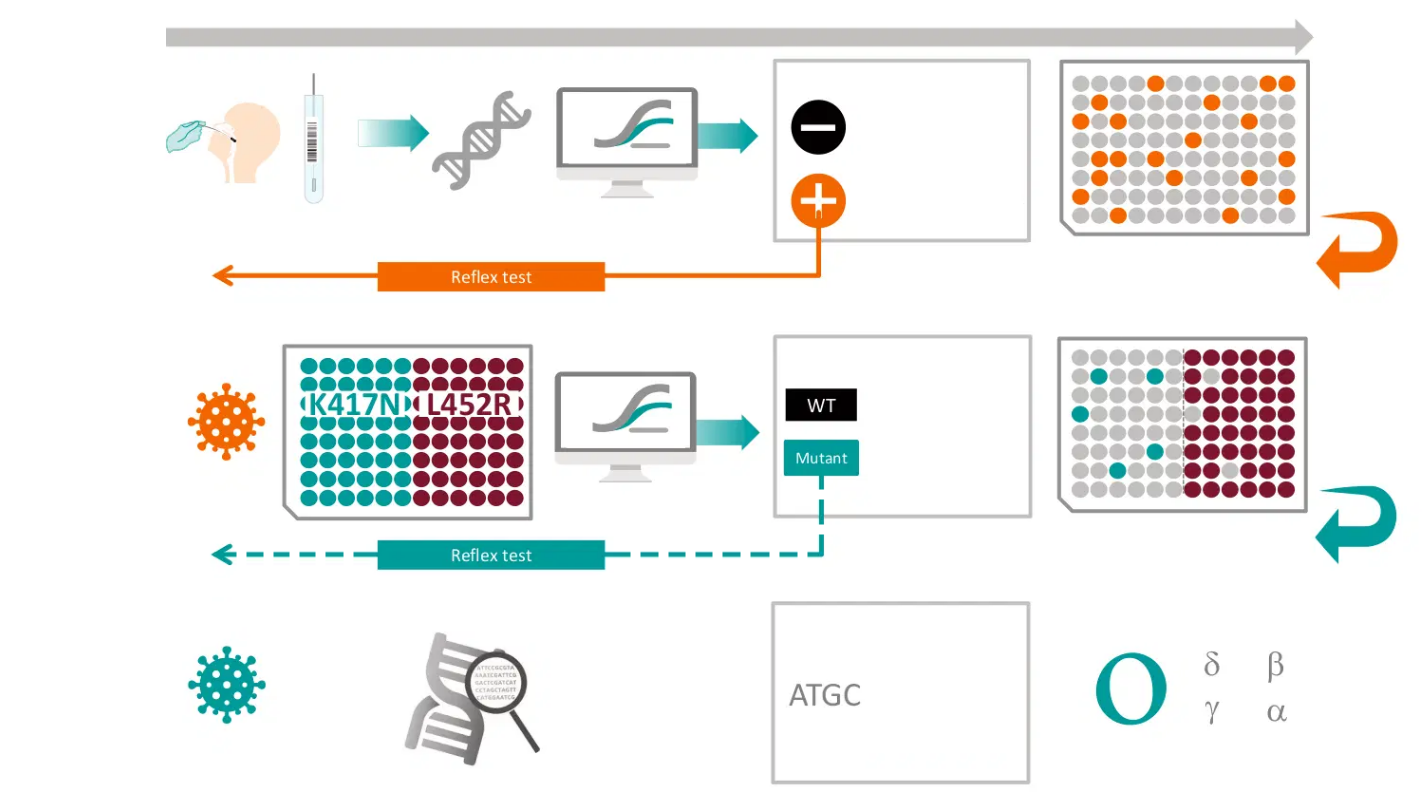
Variantes Emergentes de SARS-CoV-2
Discriminación entre Omicron y Delta, e identificación de otras variantes
¿Fue útil esta información?
*La disponibilidad de los productos/características varia en función del país y está sujeta a los distintos requerimientos regulatorios de cada uno y su disponibilidad futura no puede ser garantizada. Por favor contacte a la oficina local de representación de Siemens Healthineers en caso de requerir mayor información.
1) Etiquetado CE-IVD para uso diagnóstico en la UE. Esta prueba no ha sido aprobada ni aprobada por la FDA. Esta prueba ha sido autorizada por la FDA bajo una EUA para su uso por laboratorios autorizados. Esta prueba ha sido autorizada solo para la detección de ácido nucleico del SARS-CoV-2, no para ningún otro virus o patógeno. Esta prueba solo está autorizada durante la duración de la declaración de que existen circunstancias que justifiquen la autorización del uso de emergencia de diagnósticos in vitro para la detección y / o diagnóstico de COVID-19 bajo la Sección 564 (b) (1) de la Ley, 21. U.S.C. § 360bbb-3(b)(1), a menos que la autorización sea terminada o revocada antes.
2) Etiquetado CE para uso diagnóstico in vitro en la UE.
3) Datos archivados en Fast Track Diagnostics Luxembourg S.à r.l., una empresa de Siemens Healthineers. Los datos están actualizados al 16 de enero de 2023.
4) Solo para uso en investigación (RUO), no para fines clínicos o de diagnóstico.
5) 88 reacciones, cuando se automatizan en el sistema molecular VERSANT kPCR.